Модел in vitro за измерване на имунния отговор на малария в контекста на коинфекция с ХИВ
Въведение
Коинфекцията, инфекция с множество едновременни инфекции, е норма в естествените условия. Коинфекцията може да окаже голямо влияние върху патологията на заболяването и клиничното управление на всяка инфекция. Във връзка с коинфекцията, ваксината и ефективността на лекарствата, както и диагностичните тестове могат да бъдат повлияни отрицателно (преглед в 1). Въпреки тяхното значение, повечето изследвания на патогени разглеждат само отделни инфекции.
Маларията и ХИВ-1 (ХИВ) са водещите причини за заболеваемост и смъртност в световен мащаб. Областите на малария и ендемичност с ХИВ имат общо географско припокриване, излагайки милиони хора на риск от по-тежки клинични заболявания 2-10 Двете заболявания си взаимодействат негативно. При инфектирани с ХИВ лица се наблюдават по-високи вирусни натоварвания с ХИВ и преходни намаления на броя на CD4 + Т клетките по време на инфекция с малария, докато натоварванията с паразити от малария и риск от клинична и тежка малария се наблюдават при коинфектирани лица 2,3,5,7, 8.10 по-висока. Механизмите, чрез които ХИВ увеличава тежестта на маларията, не са напълно разбрани и налагат допълнително разследване.
Тук ние описваме метод, чрез който ин витро могат да бъдат изследвани ко-инфекция с малария и ХИВ. По-специално, този метод позволява изследване на специфични за маларията имунни отговори във връзка с ХИВ инфекция. Нашият протокол описва гъвкава система за култивиране на прясно изолирани мононуклеарни клетки от периферна кръв (PBMC) от хронично заразени с ХИВ донори и паразитирани от P. falciparum еритроцити (PfRBC), култивирани in vitro. Ефектите на HIV антиретровирусната терапия върху тези отговори могат също да бъдат изследвани, като се използват проспективно записани PBMC от донори на HIV (+) преди и след лечението.
Използва тази система за изследване на влиянието на HIV инфекцията върху специфичните за маларията вродени имунни отговори 11,12 и успя да установи, че специфичните за малария IFNy и TNF отговори са нарушени в NK клетките, NKT клетките, γδ Т клетки от донори на HIV (+) преди и след антиретровирусна терапия с HIV. Освен това успяхме да използваме тази система, за да определим, че моноцитните функции също са нарушени при донори на HIV (+), но се възстановяват след HIV антиретровирусна терапия.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Протокол
Този протокол изисква набирането на донори за серум и еритроцити да се използва за паразитна култура и ХИВ (+) и неинфектирани донори за изолиране на PBMC. Институционалните съвети за преглед трябва да одобрят всички изследвания и всички донори трябва да дадат информирано съгласие преди вземането на кръв.
ПРЕДУПРЕЖДЕНИЕ: Работата с проби от човешка кръв и паразити от човешка малария изисква предпазни мерки. Винаги носете лабораторно палто, ръкавици и работете в кабинет за биобезопасност от ниво 2. В случай на случайно перкутанно излагане на човешка малария, докладвайте за здраве и безопасност за профилактично лечение. Допълнителни проверки за безопасност също трябва да се провеждат на място за работа с ХИВ (+) кръв. Носете извод лабораторно палто. Двойна ръкавица (горната ръкавица трябва да е латекс). Извършвайте цялата работа в шкаф за биобезопасност от ниво 2. Не използвайте стъкло или остри предмети. Не използвайте водна струя помпа. Поставете всички замърсени части от разтвор на вирокс или белина за поне 1 час преди изхвърляне.1 час след нанасяне измийте всички повърхности с вирокс и UV. Имайте предвид, че всяка институция ще има свои специфични разпоредби за биосигурност, които трябва да се спазват. Докладвайте за всяка случайна експозиция на здраве и безопасност на заразена с ХИВ кръв за оценка и разглеждане на възможна профилактика след експозиция.
ЗАБЕЛЕЖКА: Налични са различни щамове на P. falciparum маларийни паразити. За тези експерименти се използва ITG, но се използват различни щамове. Отлични инструкции за замразяване и размразяване Паразитите на Plasmodium falciparum са достъпни на уебсайта MR4 13.
1. Създайте RPMI-A за маларийната култура
- Направете RPMI-0 чрез смесване на 950 ml ddH20, 1 пакет RPMI-1640 прах, 6 g HEPES, 2 g натриев хидроген карбонат и 1,35 mg хипоксантин.
- Размразете топлинно инактивиран човешки серум от два различни донора. AB донорите са най-добри, но всеки може да се използва, когато паразитите се отглеждат в червени кръвни клетки от тип О (RBC). Метене на тръби за смесване. Ако серумът съдържа частици или е дебел центрофугиране при 2000 об/мин и след това изберете течна част с помощта на филтърна единица 0,45 µm.
- Използвайки 0.2 µ m филтърна единица филтър 180 ml RPMI-0, 20 ml човешки серум (10 ml от всеки донор) и 0,5 ml 10 mg/ml гентамицин.
Забележка: Човешкият серум може да запуши филтрите, така че са необходими повече от един филтър. - Етикетирайте средната бутилка с RPMI-A, датата и източника на серума. Охладете, докато е необходимо. RPMI-A може да се помътни при охлаждане. Това е нормално, но увеличаването на облачността е признак на замърсяване.
Забележка: растежът на паразитите в различен донорен серум ще варира. Добра идея е да се тестват всички партиди човешки серум за добър растеж на паразити, преди да се използва.
2. Подготовка на човешки червени кръвни клетки за паразитна култура
Забележка: Донорите на кръв трябва да бъдат тип О.
- Съберете 7-10 ml кръв в епруветки с киселинен цитрат-декстроза (ACD). Напишете идентификационния номер на донора и датата на събиране на етикета.
- Съхранявайте кръвта при 4 ° C, докато е необходимо. За кръвен паразит използвайте култури в рамките на 1 месец.
- Избършете горната част на епруветката със 70% етанол. Извадете внимателно запушалката и я изхвърлете. Прехвърлете кръв в епруветка от 15 ml. Завъртете 3 минути при 1000 x g. Отстранете плазмата чрез аспирация.
- Излагане на червените кръвни клетки с еднакъв обем топъл RPMI-0. Въртете 5 минути при 1000 х g. Отстранете мастната кожа чрез всмукване, ресуспендиране в 5 ml RPMI-0 и повторете измиването още 2 пъти.
- Отстранете супернатантата и добавете достатъчно RPMI-A, за да се получи смес, която е 50% RBC по обем.
- Съхранявайте при 4 ° C, докато е необходимо.
3. Поддържане на паразитни култури
4. Паразитна синхронизация
ЗАБЕЛЕЖКА: Ден преди експеримента синхронизирайте паразитната култура, като обработвате с аланин. Само паразити в пръстен и незаразени червени кръвни клетки ще оцелеят при това лечение. Аланиновата синхронизация ви дава чиста трофозоитна култура на следващия ден, която може да се използва в експериментите за съвместна култура. Не забравяйте да започнете с паразитна култура, която съдържа по-голямата част от паразитите в пръстеновидната фаза.
- Приготвя се аланин чрез смесване на 8.01 g аланин (300 mM) и 0.365 g Tris (10 mM) в 300 ml ddH 2 O. Довежда се рН до 7.4. Филтърът се стерилизира с помощта на 0,2 µ m филтърна единица.
- Предварително загрейте разтвора на аланин до 37 ° C.
- Завъртете паразитната култура (5 мин. Х 1000 х г) и отстранете средата.
- Пелети в 19 обема разтвор на аланин (1 ml опаковани RBC до 19 ml разтвор на аланин). Инкубация за 15 минути при RT.
- Въртене 5 минути x 1000 x g. Супернатантът е засмукан. Измийте веднъж в RPMI-0. Супернатантът се аспирира и ресуспендира в RPMI-A и се настройва хематокрит
3%. Същото като колбата и връщане до 37 ° C
Забележка: За експерименти за съвместно култивиране е необходима минимум 5% паразитомия на трофозоити, като 10% паразитемия се счита за оптимална.
5. Подготовка на паразити и еритроцити за експерименти за съвместно култивиране
- Използвайте съотношение 3 PfRBC на PBMC в експерименти за съвместно култивиране, за да предизвикате възпалителен отговор. За да се изчисли общият PfRBC, количествено определете паразитемията, като вземете тънка кръвна намазка, както е описано в 3.5, и хематокрит, като преброите броя на червените кръвни клетки на ml паразитна култура с преброителна камера.
Брой на PfRBC =% паразитемия x обща еритроцити/ml x ml култура. Например: 10 ml култура при 10 x 10 6 RBC/ml и 10% паразитемия е равно на 0,1 x 10 6/ml x 10 ml = 10 x 10 6 PfRBC. - Завъртете паразитната култура за 5 минути при 1000 xg (RT). Аспиратна среда и ресуспендиране при 6 х 10 6 PfRBC на ml в RPMI-S + (500 ml RPMI-1640, допълнена с L-глутамин и HEPES, 10% топлинно допълнена инактивирана FBS, 1,5 ml гентамицин, 5 ml 100 mM натриев пируват, 5 ml от 10 mM MEM несъществени аминокиселини, 5 ml от 5 mM β-меркаптоетанол).
- Контролната кръв (неинфектиран червен еритроцит от същия донор, използван за задържане на паразитна култура), изчислен хематокрит и ресуспендиран в RPMI-S + в същия брой еритроцити на ml върху паразитната култура.
6. Изолиране на човешки мононуклеарни клетки от периферна кръв (PBMC)
7. Култура за коинфекция на малария/ХИВ
8. Откриване на имунни отговори на малария
ЗАБЕЛЕЖКА: Правете експерименти в културата в продължение на 4 дни. През това време не се изисква промяна на средата. Оптималното време ще зависи от типа клетка, която ви интересува, и от зададения въпрос. Инкубацията от 12 до 48 часа е оптимална за отговорите на моноцитите към PfRBCs, докато лимфоцитните отговори са най-добре наблюдавани при 72 до 96 часа. Времето ще трябва да бъде оптимизирано въз основа на експерименталния въпрос. По-кратки периоди (2-4 часа) могат да се използват, ако взаимодействието между непокътнатите PfRBC и PBMC представлява интерес.
- Въртете плата при 300 × g за 3 минути върху клетките на пелети. От всяка ямка се събират 700 μl културална супернатанта.
- Завъртете супернатанта при 1000 х g за 5 минути, за да избегнете чужди тела.
- Аликвотно изчистена супернатанта при необходимост, етикетиране, прехвърляне и LeistRMED при -20 ° C до анализ на секретираните фактори.
- Анализирайте отговорите на цитокини/хемокини чрез ELISA или чрез сглобяване на зърна (следвайте препоръчаните от производителя протоколи).
- Съберете клетки, останали в плаката, в разтвор за стабилизиране на РНК и ги използвайте за анализ на експресията на иРНК, използвайки количествена PCR в реално време 14-16.
9. Вътреклетъчна поточна цитометрия за клетъчно-специфични цитокинови отговори с използване на P. PBMC кокултивиран фалципарум, инфектиран RBC
Забележка: Както бе споменато по-горе, дължината на съвместната култура ще зависи от типа клетка, която представлява интерес. Ако се интересувате от моноцитни отговори, е необходим по-кратък инкубационен период на PfRBC. В пъти по-дълго за вродените лимфоцитни отговори (Т клетки, NK клетки, NKT клетки) и още повече за CD4 и CD8 Т клетки. Изисква се оптимизация.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Представителни резултати
Графиките показват нивата на IFN & ggr; Производство на NKT клетки (Фигура 2), с CD56 + CD3 + γδ- порта за запазване на NKT клетъчната популация (данните не са показани). Клетките се култивират 72 часа преди оцветяването. Веднъж оцветени, 100 000 CD3 + клетки бяха записани на поточния цитометър, за да се получат достатъчно големи популации от NK, NKT и γδ клетки (клетки от интерес). На всяка графика са показани минимум 5600 NKT клетки. Производството на TNF се получава по същия начин (данните не са показани). Графиките ясно показват, че IFN & ggr; Продукцията е по-ниска в клетките на ХИВ (+) индивиди спрямо ХИВ (-) индивиди, изложени на PfRBC.
Анализът на поточната цитометрия е много субективен. Следователно е важно да имате всички подходящи контроли за всеки експеримент (вж Фигура 2). Фоновите стойности се изчисляват с помощта на проби от FMO, което дава възможност за истинско представяне на оцветяването с цитокини.Клетки, стимулирани с РМА/йономицин, са използвани като положителни контроли (данните не са показани). PMA и йономицин са мощни стимулатори на производството на Т-клетъчни цитокини. Липсата на производство на IFN в тези проби най-вероятно би била проблем с протокола за оцветяване. Други променливи като клетъчна жизнеспособност или неактивни реагенти обаче също могат да бъдат виновни.
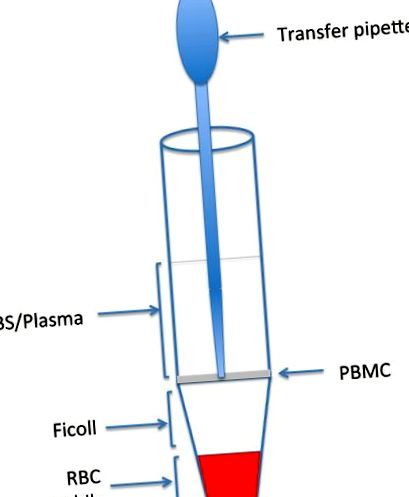
Фигура 1. Илюстрация на Ficoll Gradient Post Spin доказателство за позицията на PBMC.
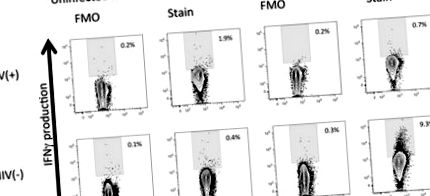
Фигура 2. Производство на IFN y от естествени клетки-убийци. Диаграмите на потока са получени чрез измерване на CD56 + CD3 + γδ клетки (минимум 5600 събития). Производството на IFNy се открива в пробата за HIV (-), стимулирана с P. заразени с фалципарум червени кръвни клетки. Този цитокинов отговор вече не е очевиден в контекста на хронична ХИВ инфекция. Моля, кликнете тук, за да видите по-голяма версия на тази фигура.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Дискусия
Нашият протокол е оптимизиран за изследване на коинфекцията с ХИВ-малария най-реалистично in vitro. Първо, за културата на маларийните паразити са необходими пресни човешки еритроцити и серум. Това е от решаващо значение за поддържането на здрава популация от маларийни паразити. Паразитните лизати не могат да бъдат заместени с живи паразити, тъй като производството на цитокини е много по-бързо и по-интензивно, когато се използва жив П. заразена с фалципарум RBC (PfRBC) 17.18. Освен това, активирането на клетъчни типове, като NK клетки, изисква общи PfRBCs и не се справя ефективно с паразитни лизати. Това може да се дължи на необходимостта от директен контакт между PfRBC и левкоцитите или може да се дължи на нестабилната природа на получения от паразита лиганд, който взаимодейства с рецепторите на клетъчната повърхност 18. Културите на малария PfRBC също трябва да бъдат добре синхронизирани (протокол 4) преди експеримента. Синхронизираните PfRBC подобряват възпроизводимостта на експериментални данни. Въпреки че този протокол deSchreiber използва трофозоитен етап PfRBC за съвместно култивиране, той може лесно да бъде модифициран за изследване на пръстеновидния етап PfRBC.
Човешките левкоцити са изкуствено инфектирани с ХИВ и методът е използван в проучвания на Malaria-HIV Research Co-Infection Research 20. Това обаче не моделира имунната дисрегулация, която води до хронична ХИВ инфекция. В тази система за съвместно култивиране използваме PBMCs, изолирани от хора, които са хронично заразени с HIV-1. Ако се изисква проучване за участниците, важно е внимателно да се подбере тази популация. Критериите за включване и изключване са от решаващо значение за осигуряване на минимална променливост и максимална възпроизводимост. Нашите критерии бяха ясна дефиниция на хронична ХИВ инфекция (> 1 година заразена с ХИВ, с намаляване на броя на CD4 + Т клетките> 50 клетки/mm 3/година) и изключване на всеки с едновременна инфекция. Това гарантира, че получените резултати могат да се отдадат на ефектите от хроничната ХИВ инфекция, а не на някаква друга инфекция. Освен това, тъй като се интересувахме от вродения имунен отговор на изключена малария, ние бяхме донори, които са имали предишна маларийна инфекция.
ХИВ инфектираните контроли се използват за всеки ХИВ (+) донор, по всяко време за вземане на проби, което позволява нормализиране на данните. Трябва да се направи опит да се съпоставят контролите със съответните им ХИВ (+) донори за най-малко възраст, но за предпочитане и пол (въпреки че в нашето по-ранно проучване 12 не сме наблюдавали значителна разлика в клетъчните подгрупи или цитокиновите отговори между жени и мъже Неинфектирани от ХИВ участници). Ако е планирано бъдещо вземане на проби, поддържането на същия заразен с ХИВ контрол за всяко време за вземане на проби е от полза. Експерименталните отговори варират в зависимост от няколко фактора, включително здравето на PfRBCs, тяхната степен на синхронизация, нива на паразитемия и зрялост на PfRBCs и нива на хематокрит. Трябва да се внимава колкото се може повече от тях да бъдат в хармония между експериментите. Нормализирането към ХИВ-инфектиран контрол позволява някои отчитане на тези променливи.
Наличието на пресни клетки е от първостепенно значение, за да се избегнат изкуствени резултати. Пробите за замразяване и размразяване могат да окажат значително влияние върху жизнеспособността на клетките 21,22, производството на цитокини 23-26 и маркерите за фенотип на клетъчната повърхност 27.
Ако моноцитите представляват особен интерес, важно е стъклото да не се използва в протокола. Трябва да се наблюдават моноцити върху стъкло и много други пластмаси 28. Ние използваме пластмасови пипети от полипропилен, пипети и тръби навсякъде, за да сведем до минимум адхезията на моноцитите и окончателното отстраняване от изследваните клетъчни популации.
Описаният протокол е универсален, който може да се използва за изследване на отговорите в рамките на часове или дни в зависимост от клетките, които представляват интерес. За оптимално индуцирано от PfRBC производство на цитокини от вродени лимфоцити, ние измерихме изходната цитометрия на изходното ниво след 2 или 3 дни. Когато се разглеждат моноцити, се препоръчват по-ранни точки от време (1 или 2 дни). Тази система позволява да се диференцират множество клетъчни типове и клетъчни отговори чрез поточна цитометрия, секреторни отговори да се измерват в клетъчни супернатанти и да се оценяват експресионните профили в екстрахирана РНК. Освен това, използването на антитела за блокиране или неутрализиране на специфични рецептори; цитокините могат да се използват в тази система за допълнително дисекция на механизмите. Успешно използвахме IL-18 рецепторна блокада, за да внушим IL-18 рецептор в индуцирани от PfRBC IFN отговори 12. Тази система предоставя реалистичен метод, чрез който се оценява набор от вродени имунни отговори на малария, свързани с ХИВ инфекция.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
- Рецепта за отслабване доматена супа с кнедли
- Диетата с грозде идеална за октомври
- Най-добрата програма за отслабване - да се чувствате добре в собственото си тяло
- Защо конете отслабват - как да направим щастлив дом за вашия домашен любимец
- 500 килограма Хавай над дъгата юни 2011 NZZ Фолио