Производство на инсулин
Диабетът е болестта номер едно в цивилизацията. При тип I островчетата Лангерханс се унищожават от имунната система. Този тип се среща преди 20-годишна възраст. При тип II (диабет в напреднала възраст), който се среща при повечето диабетици, има нормални или повишени нива на инсулин в кръвта, но промените в мястото, където хормонът действа, ще намалят неговата функционалност.
Нуждата от инсулин е изключително висока. Използването на генетично модифицирани бактерии улеснява покриването днес, отколкото преди. Преди да се използват бактерии, инсулинът се получава от панкреаса на свине или говеда. Диабетик използва панкреаси от около 50 прасета, за да покрие годишните си нужди.
Какъв е проблема?
Обяснява кои вътрешно-клетъчни процеси протичат в бета клетките, които водят до активен инсулин.
Как може да се произвежда човешки инсулин с помощта на бактерии.
Инсулин - производство при хора
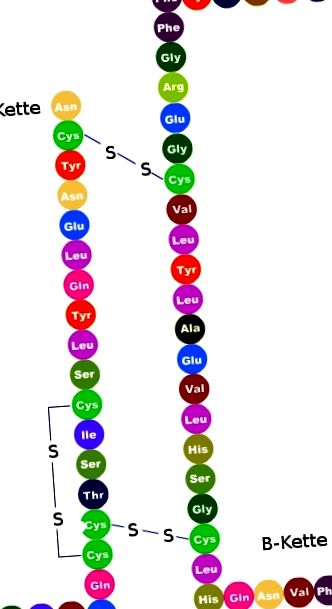
Инсулинът е много малък хормон, изграден от две вериги аминокиселини (А и В вериги). Веригата А се състои от 21 аминокиселини, а веригата В от 30 аминокиселини.
И двете вериги първо се синтезират като част от верига 110 АА. Тази дълга форма е препроинсулин.
24 аминокиселини от този предшественик сигнализират на ендоплазмения ретикулум да го поеме. Тази сигнална последователност се разделя по време на запис.
Останалите 86 аминокиселини образуват проинсулин (А, В и С вериги). A и B веригите си взаимодействат чрез дисулфидни мостове (-S-S-).
След това С-веригата (С-пептид) се отделя ензимно.
С-пептидът осигурява пространствено правилно подравняване на веригите А и В (образуване на дисулфидни мостове); това е единственият начин за функциониране на инсулина.
Модификацията на протеинов предшественик по време или след транслацията е известна като обработка на протеин.
Как да си направим човешки инсулин с Е. coli
Етап 1
Модифицираната проинсулинова мРНК се изолира и синтезира чрез обратна транскриптаза, за да образува РНК-ДНК хибрид.
стъпка 2
Единичната верига на ДНК се допълва с помощта на ДНК полимераза. CDNA е готова.
стъпка 3
Стартовият кодон е ензимно прикрепен към кДНК на инсулин (А.: TAC за AUG → метионин, начален кодон), както и "лепкави краища" (Б.: лепкави краища) приложен.
Резултат
Така завършената „пътническа ДНК“ се състои от „лепкавите краища“, началния кодон и проинсулиновия ген за веригите B, C и A.
Рекомбинирайте - включете във вектора
Получаваната по този начин чужда ДНК вече е включена във вектора pBR322. Векторът съдържа ген за бета-галактозидаза и ген за резистентност към ампицилин.
Етап 1
Чрез рязане с Eco RI, чуждата ДНК трябва да бъде включена в средата на гена за галактозидаза.
стъпка 2
Създават се „лепкави“ краища, които допълват чуждото ДНК.
стъпка 3
Взаимодействието на „лепкавите“ краища вмъква чуждото ДНК в плазмида.
Стъпка 4
Пропуските се затварят от ДНК лигази. Рекомбинираният плазмид е готов.
Значение на оперона за генната експресия
Чрез включване на проинсулиновия ген в галактозидазния ген, lac оперонът може да се използва за генна експресия. В същото време галактозидазният протеин предпазва инсулиновия компонент от собствените клетъчни ензими, протеазите, които основно разграждат незабавно по-малките протеини.
Съвременните методи използват гена на триптофан синтазата, за да поемат проинсулиновия ген, който се контролира чрез ензимна репресия. Типтофановият оперон съдържа също механизъм, който увеличава генната експресия в случай на дефицит на триптофан, който може да се използва технически добре.
Трансформиране - Избор - Клониране
Плазмидите се въвеждат в Е. coli чрез трансформация. За селекция се използва резистентност към ампицилин. Рекомбинираните бактерии се размножават във ферментатори.
От съображения за безопасност, инсулиновите вериги А и В се експресират отделно в два различни щама на Е. coli за по-дълъг период от време, за да се изключи възможността бактериите да синтезират човешки инсулин. Бактериите, оборудвани по този начин, биха предизвикали захарен шок, ако попаднат в червата ни.
Express - Промяна
Експресията на гена се задейства чрез добавяне на лактоза. Експресира се бета-галактозидазният ген с вграден инсулинов ген. Създава се слет протеин от галактозидаза и проинсулин.
Генният продукт се изолира от хранителната среда чрез центрофугиране. С цианоген бромид бета-галактозидазната част се отделя от проинсулина чрез разрушаване на аминокиселината метионин, вградена в нея.
Проинсулинът се модифицира до инсулин с ензима трипсин. Тъй като бактериите нямат необходимия ензим, той трябва да бъде добавен след почистване.
Производство на интерферон от бактерии
Важността на експресията на човешки гени в клетки гостоприемници (бактерии, дрожди) става ясно и от следващия пример за интерферон. Като активна съставка при лечението на рак или множествена склероза, той е бил достъпен само за няколко души, преди да бъде произведен с генетично модифицирани бактерии. Дотогава интерферонът се получава от кръвни клетки. За 400 mg интерферон са необходими 50 000 литра кръв. Днес той може да бъде произведен във всякакво количество, използвайки рекомбинирани клетки на Е. coli.
- Ходенето не работи
- Диабет тип 2, за да може да бъде обърнат - FOCUS Online
- Дресинг от ферми на Уолдън - нискокалоричен без захар
- Кой повлия на желания секс и имаше успех?
- Проучване върху затлъстели хора в Северен Рейн-Вестфалия Всеки трети човек намира мазнините неестетични Kölner Stadt-Anzeiger