Кетогенна диета за дефекти на транспортера на глюкоза
Синдромът на дефицит на глюкозен транспортер тип 1 (GLUT1DS) е много рядко, авто-сомално-доминиращо наследствено, неврометаболично заболяване, за което за първи път се съобщава от De Vivo et. ал. е описана като епилептична енцефалопатия в New England Journal of Medicine въз основа на 2 доклада за случая. И двамата пациенти започнаха да имат мозъчни припадъци на възраст около 3 месеца, които не реагираха на антиконвулсанти. Първата индикация за дефект на глюкозен транспортер е необяснима хипогликорахия, при която съотношението на концентрацията на глюкоза в цереброспиналната течност към концентрацията на глюкоза в кръвта е 0,19-0,35 вместо нормалната стойност от 0,65. Лечението с KD доведе до почти нормално неврологично развитие и спиране на гърчовете и при двамата пациенти. (Vivo, D C de et al., 1991)
Мутациите в гена SLC2A1, който кодира GLUT-1 транспортера, са отговорни за GLUT1DS. При хората това се изразява върху мембраната на еритроцитите и ендотелните клетки на мозъчните капиляри (кръвно-мозъчна бариера) и, наред с други неща, катализира независимия от инсулина транспорт на глюкоза. Най-често срещаните мутации на гена SCL2A1 са точкови мутации, последвани от делеции, мултимесии на кадър и мисиссенс. Фактът, че пациентите с еднакви мутации не винаги имат еднакви симптоми, предполага допълнителни механизми като хистон или пост-транслационни модификации, които могат да допринесат за патофизиологията на заболяването. (Nickels K и Wirrell E, 2010; Veggiotti P и Giorgis V de, 2014)
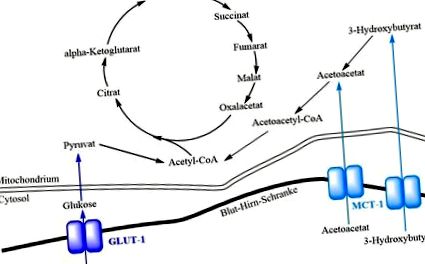
Церебралният енергиен дефицит, причинен от недостатъчен транспорт на глюкоза в мозъка, може да бъде частично компенсиран от KD, тъй като кетонните тела се абсорбират чрез MCTs независимо от GLUT-1 (виж фигурата). Тъй като метаболизмът на глюкозата може да бъде заобиколен, KDs са терапията на избор. Докато KD обикновено се преустановява в юношеството при епилепсия, при GLUT1DS това е форма на лечение през целия живот. (Klepper J, 2012)
- Корейска диета - кетогенна диета и хранене
- Инсулинова резистентност как кетогенната диета може да помогне на KetoUp Blog
- Модифицирана диета на Аткинс Кетогенна диета
- Средиземноморска риба тон кето пица рецепта кетогенна диета; KetoMeals
- Изграждане на мускули с кето Част 1 Целенасочената кетогенна диета