Инхибитори на протонната помпа за интензивно лечение
Внимателен подбор на пациента и стратегии за управление на страничните ефекти
Инхибитори на протонната помпа за пациенти в интензивно лечение
Внимателен подбор на пациента и стратегии за управление на странични ефекти
Обобщение
Свързаните със стреса промени в стомашно-чревната лигавица са важно усложнение в интензивната медицина. Инхибиторите на протонната помпа (ИПП) са от изключително значение при лечението и профилактиката на свързаните с киселини увреждания на лигавицата. Стойността на ИПП в профилактиката на свързаните със стреса промени в лигавицата все още не е ясна. Въпреки че ИПП се понасят много добре, трябва да се имат предвид странични ефекти като повишен риск от инфекция, увреждане на бъбреците, лекарствени взаимодействия, електролитни измествания и нарушения на микробиомния състав.
Резюме
Свързаните със стреса лезии на стомашно-чревната лигавица могат да усложнят критичното заболяване. Инхибиторите на протонната помпа (PPI) са утвърденият терапевтичен стандарт за увреждане на лигавицата, свързано с киселина. Ролята на PPI за предотвратяване на свързаните със стреса увреждания на лигавицата все още не е напълно ясна. Въпреки че ИПП се понасят добре, трябва да се имат предвид странични ефекти като повишен риск от инфекция, увреждане на бъбреците, лекарствени взаимодействия, електролитни нарушения или промени в микробиомния състав.
Въведение
Особено след като ИПП също са на разположение без рецепта, употребата им като „лекарство за начин на живот“ за лечение на различни стомашно-чревни оплаквания се е увеличила значително. Поради ниските или трудно откриваеми странични ефекти, ИПП също са били използвани извън ясните индикации. Такъв е случаят и в интензивната медицина, където стресовият гастрит и стрес язвата са страшни усложнения.
Честота и патофизиология на свързано с киселина увреждане на лигавицата при критично болни
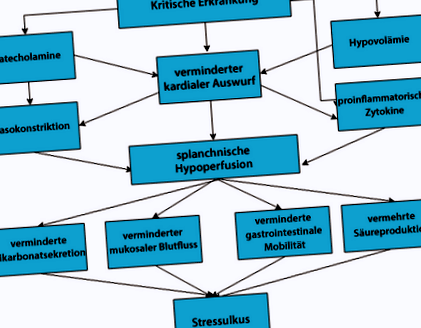
При по-стари ендоскопски проучвания честотата на гастроинтестинално увреждане на лигавицата при критично болните е 75–100%, окултно кървене се наблюдава при 5–25%, явно кървене при около 4%. Клинично значимото кървене е още по-рядко и се наблюдава само при около 1,5% от критично болните. В центъра на патофизиологията е спланхнична хипоперфузия, която води до дисбаланс между защитни и патогенни фактори в лигавицата на горната част на стомашно-чревния тракт (фиг. 1). Стомашната киселина е само един от няколкото фактора за развитието на свързаните със стреса промени в лигавицата.
Патофизиологични механизми на развитие на свързано със стреса увреждане на лигавицата при критично болни. (Въз основа на [8])
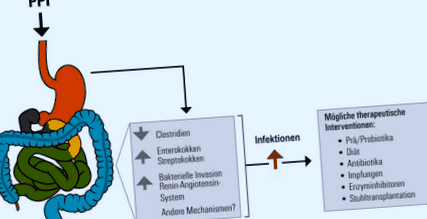
Възможни причини за повишен риск от инфекция от инхибитори на протонната помпа (PPI) и потенциални стратегии за управление на странични ефекти, свързани с PPI. Адаптирана препечатка с приятелски. Одобрение от Medicom Verlags GmbH от [9]
Рискови фактори за развитие на стресова язва са необходимостта от механична вентилация за повече от 48 часа и коагулопатия. Комбинацията от двата рискови фактора увеличава риска от клинично значимо кървене до 8,4%. Други рискови фактори като шок, сепсис, чернодробна недостатъчност, бъбречна недостатъчност, множествена травма, изгаряния> 35% от телесната повърхност, трансплантация на органи, травматично увреждане на мозъка, травма на гръбначния мозък, анамнеза за язва или анамнеза за кървене от горната част на стомашно-чревния тракт (GI) не могат да бъдат толкова ясни да бъдат свързани с развитието на стресова язва.
Предотвратяване на промени в лигавицата, свързани със стреса
Проучванията за превенция на свързаните със стрес лигавични кръвоизливи в горните части на стомашно-чревния тракт датират до голяма степен от 80-те години на миналия век и са проведени със „стари“ терапии за киселинно запушване (Н2 блокери, сукралфат) - оттогава се развиват както лекарството за интензивно лечение, така и терапията на свързаните с киселини заболявания и острите стомашно-чревни. Кървенето се развива естествено.
Въпреки че повечето проучвания за профилактика на стресова язва не са проведени с ИПП и стомашната киселина играе подчинена роля в патогенезата, използването на ИПП сега доминира както в клиничната практика, така и в съответните насоки за специалисти. Наблюдателно проучване през 2013 г. показа, че 70% от пациентите на интензивно отделение получават PPI. Във видни насоки за специалисти, като напътствията на Кампанията за оцеляване на сепсиса или концепцията FAST-HUG, се препоръчва използването на ИЦП, като нивото на доказателства за тази препоръка е правилно посочено като ниско. FDA също така одобри омепразол за предотвратяване на свързано със стреса увреждане на лигавицата.
Използването на ИПП в интензивната медицина е толкова широко разпространено, че са необходими дори сложни проучвания за осъществимост, за да се определи дали е възможно изобщо да не се използва ИПП в проучване при пациенти с интензивно отделение. Публикуваните до момента рандомизирани контролирани проучвания са имали сравнително малък брой случаи, някои от тях са били едноцентрови проучвания и, когато се разглеждат като цяло, не могат да докажат, че ИПП са по-ефективни от Н2 блокерите или плацебо. Раздел 1 обобщава резултатите от мета-анализите по тази тема. Поради това големи проучвания по тази тема са много важни и в момента се провеждат: Проучването SUP-ICU с 3350 планирани пациенти в Европа е напълно назначено през октомври 2017 г. Проучването POP-UP е публикувано през есента на 2016 г., което не открива предимство, но и недостатък на приложението на ИПП в сравнение с плацебо при 214 проветриви пациенти. Тъй като ползата от ИПП за предотвратяване на свързано със стреса увреждане на лигавицата при критично болни все още не е ясно доказана, въпросът за безопасността на терапията се поставя на фокус.
Възможни странични ефекти на ИПП, когато се използват в интензивно лечение
Германският фармаколог Г. Кушински каза: „Ако се твърди, че дадено вещество няма странични ефекти, има силно подозрение, че то също няма и основен ефект.“ От друга страна, от това може да се заключи, че лекарство, което има ясно доказуем ефект, също ще има странични ефекти.
Следователно възниква въпросът дали и как ИПП биха могли да навредят на критично болните, особено след като тяхната употреба обикновено е необходима само за кратко време (по-малко от 30 дни) и има наистина сериозни последици, като повишена смъртност, очевидно само след един към един две години използване на PPI стават релевантни.
Страничните ефекти, свързани с лекарството за интензивно лечение, са повишен риск от инфекция, лекарствени взаимодействия, повишен сърдечно-съдов риск, остър интерстициален нефрит и електролитни нарушения. Вероятно от по-малко значение в острата фаза или с относително кратка продължителност на употреба са повишен риск от остеопороза и фрактури, недостиг на витамини и повишен риск от хронично увреждане на бъбреците и възможна връзка с деменция.
„Изследванията показват връзка между употребата на ИПП и инфекциите“
Лекарствените взаимодействия, свързани с лекарството за интензивно лечение, също могат да бъдат причинени от намеса в метаболизма на други лекарства. Те включват бензодиазепини, макролиди, циталопрам и трициклични антидепресанти. Едновременната употреба на PPI повишава ефективността на тези вещества. Съществува и друго подходящо взаимодействие с клопидогрел, който се активира само от цитохрома CYP2C19. PPI инхибират този изоензим по дозозависим начин, което води до намалено активиране на клопидогрел и следователно до намалено инхибиране на функцията на тромбоцитите. Дали това взаимодействие е клинично значимо все още не е окончателно изяснено. Някои ретроспективни проучвания показват по-висок процент на смъртни случаи, повторни хоспитализации и съдови интервенции с комбинацията от клопидогрел и PPI. Мета-анализът обаче не може да потвърди тази връзка.
В големи кохортни проучвания е установена връзка между приема на PPI и сърдечно-съдови събития и повишена сърдечно-съдова смъртност, независима от клопидогрел. Причинна връзка също не може да бъде показана тук. Така че е възможно също приемът на ИПП да е само показател за тежко болни хора с по-слаб шанс за оцеляване.
„PPI увеличава или намалява ефекта на други лекарства“
Острият интерстициален нефрит е причина за остра бъбречна недостатъчност в 1–3% от случаите, като най-честият фактор са лекарствата (най-често НСПВС, пеницилини или сулфонамиди). Съществуват серии от случаи и кохортно проучване за ИПП, които описват повишен риск от интерстициален нефрит (коефициент на риск 3,0) при прием на ИПП. В кохортното проучване няма индикации, че има разлики между различните ИПП, така че може да се приеме групов ефект.
От електролитните нарушения хипомагнезиемията изглежда особено важна в интензивната медицина. Недостигът на магнезий може да доведе до сърдечни аритмии, нервно-мускулни или неврологични проблеми. Механизмът зад това вероятно е инхибиране на TRPM 6 и 7 катионни канали от PPI, чрез който магнезият се транспортира в интерстициума. Въпреки че хипомагнезиемията обикновено се наблюдава само след прием в продължение на години, има отделни съобщения за поява след 14 дни, особено когато диуретиците се приемат едновременно. След прекратяване на ИПП нивото на магнезий обикновено се нормализира в рамките на няколко дни.
Изглежда рискът от инфекция и усложнения е повишен, особено при уязвими групи пациенти, например с чернодробна цироза. ИПП могат да увеличат риска от развитие на алкохолно чернодробно заболяване, особено от размножаване Enterococcus в червата, увеличаване. ИПП повишават риска от спонтанен бактериален перитонит (съотношение на коефициентите 2,9) и в зависимост от дозата от чернодробна енцефалопатия. Все още не е напълно ясно дали ИПП повишават риска от смъртност при пациенти с чернодробна цироза.
Стратегии за управление на страничните ефекти
Въпреки това, тъй като ИПП често са необходими в интензивната медицина, дори при внимателен подбор на пациента, трябва да се помисли и за това как най-добре да се сведат до минимум страничните ефекти. Тъй като ефектите върху чревния микробиом изглежда са отговорни за голяма част от съответните странични ефекти, влиянието върху чревния микробиом е интересно. Чревният микробиом може да бъде повлиян, наред с други неща, от прилагането на пре-, про- или синбиотици. Първите проучвания върху пробиотици за управление на странични ефекти при прилагане на ИПП вече са в ход, но резултатите все още не са налични.
заключение за практика
Сега знаем, че свързаните със стреса увреждания на лигавицата са често срещани при критично болните, но рискът от стресови язви и кървене е доста нисък. Дали киселинното потискане намалява този риск, все още не е окончателно определено.
Все още не е ясно дали ИПП, които постигат бързо и ефективно потискане на киселината, са по-подходящи от други стратегии (Н2 блокери или сукралфат) за предотвратяване на свързано със стреса увреждане на лигавицата.
Въпреки че ИПП имат редица релевантни странични ефекти при критично болните, оценката на ползата и риска на ИПП при критично болните все още не може да бъде извършена окончателно. По-специално, влиянието върху чревния микробиом е от голямо значение.
Тъй като критично болните показват екстремна дисбиоза на чревния микробиом малко след постъпване в интензивно отделение и тази дисбиоза е възможна причина за инфекции или заболявания на стомашно-чревния тракт, използването на ИПП в тази уязвима кохорта от пациенти трябва да бъде внимателно обмислено.
По-специално, не трябва да се забравя прекратяването на ИПП след острата фаза, ако няма индикации за продължителна терапия.
Освен това трябва да се вземе предвид и факторът на разходите, тъй като въпреки значителното намаление на цените на ИПП след изтичане на патентите, ИПП все още са по-скъпи от Н2 блокерите, например.
Тъй като вътреболничните инфекции са едно от най-честите усложнения при критично болните и допринасят значително за заболеваемостта и смъртността, аспектът на повишения риск от инфекция определено трябва да бъде разгледан по-внимателно, преди ИПП да се използват общо за профилактика на стрес язва в случай на липсващи данни в заключението за аналогията. Надяваме се, че проучването SUP-ICU с 3350 пациенти скоро ще предостави ценна информация за това.
литература
Alshamsi F et al (2016) Ефикасност и безопасност на инхибиторите на протонната помпа за профилактика на стресова язва при критично болни пациенти: систематичен преглед и мета-анализ на рандомизирани проучвания. Crit Care 20 (1): 120. https://doi.org/10.1186/s13054-016-1305-6
Liu B et al (2015) Рискове и ползи от профилактиката на стресова язва при възрастни пациенти с неврокритични грижи: систематичен преглед и мета-анализ на рандомизирани контролирани проучвания. Crit Care 19: 409. https://doi.org/10.1186/s13054-015-1107-2
Messori A et al (2014) Интравенозни инхибитори на протонната помпа за профилактика на стресова язва при критично болни пациенти: определяне на статистическа еквивалентност според основани на доказателства методи. Int J Clin Pharmacol Ther 52 (10): 825-829
Krag M et al (2014) Профилактика на стресова язва срещу плацебо или липса на профилактика при критично болни пациенти. Систематичен преглед на рандомизирани клинични проучвания с мета-анализ и пробен последователен анализ. Интензивно лечение Med 40 (1): 11-22
Alhazzani W et al (2013) Инхибитори на протонната помпа срещу антагонисти на хистамин 2 рецептора за профилактика на стресова язва при критично болни пациенти: систематичен преглед и мета-анализ. Crit Care Med 41 (3): 693-705
Alhazzani W et al (2017) Спиране на пантопразол за профилактика на стресова язва при критично болни пациенти: пилотно рандомизирано клинично изпитване и мета-анализ. Crit Care Med 45 (7): 1121-1129
Alhazzani W et al (2017) Ефикасност и безопасност на профилактиката на стресова язва при критично болни пациенти: мрежов мета-анализ на рандомизирани проучвания. Интензивно лечение 44 (1): 1-11. https://doi.org/10.1007/s00134-017-5005-8
Bardou M (2015) Свързано със стреса лигавично заболяване при критично болен пациент. Nat Rev Gastroenterol Hepatol 12 (2): 98-107. https://doi.org/10.1038/nrgastro.2014.235
Stadlbauer V (2017) Всеки интензивен пациент има ли нужда от инхибитор на протонната помпа? ИНТЕНЗИВНИ НОВИНИ 21 (5): 15
- Отслабването с упражнения три пъти седмично е достатъчно SpringerLink
- Намаляване на теглото чрез леки автомобилни прозорци SpringerLink
- Подпомагане загубата на тегло с лираглутид SpringerLink
- Кашлица, загуба на телесно тегло и намаляване на способността за упражнения SpringerLink
- Регулиране на осмо- и обема в Hirudo medicalis SpringerLink