Борна киселина - биология
Молекулярен компас за подравняване на клетките
Какво кара листата да стареят през есента
Демокрацията на лешоядите токачки
Околната среда на Ekembo: Хората също живееха в открити пейзажи
| Генетика | Земеделие, горско стопанство и животновъдство
Сортът пшеница е създаден чрез кръстосване на диви треви
| Генетика | Земеделие, горско стопанство и животновъдство
Ечемик Pangenom: Важен етап по пътя към стъкларския завод
С намален прием на храна, по-дълъг живот
Методът без животни прогнозира токсичността на наночастиците
Клетъчна миграция: новооткрита функция на известен протеин
Борна киселина
171 ° C (разлагане) [3]
бедни на вода (50 g · l -1 при 20 ° C) [1]
Борна киселина (също: Ортоборна киселина), H3BO3, е най-простата кислородна киселина на бор. Техните соли се наричат борати.
Възникване и извличане
Свободната борна киселина се намира във източниците на водни пари (фумароли) в Централна Италия в Тоскана; киселината може да се получи от тези източници чрез изпаряване в лъскави тромбоцити. Борната киселина се намира в Тоскана и като минерал сасолин. Алкалните и алкалоземните соли, като минерала кернит Na2B4O7 · 4 H2O, обаче са от голямо значение. Подобен, по-рядък минерал е бораксът, който съдържа 8 или 10 еквивалента кристална вода. В днешно време обаче това се получава главно от кернит. Чрез обработка на боракс със солна киселина или сярна киселина може да се освободи борна киселина.
характеристики
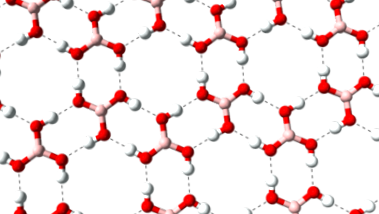
Чистата борна киселина образува люспести, безцветни, лъскави кристали, които имат точка на топене 171 ° C. Те образуват слоева структура, в която водородните връзки се образуват между отделните молекули на борната киселина. Разстоянието между два слоя е 318 пикометра (pm).
Първоначално е трудно да се разтвори във вода, но този процес се ускорява с увеличаване на концентрацията. Разтворът е слабо кисел. Когато ортоборната киселина се нагрява, водата се отделя и се образува метаборната киселина HBO2, която се среща в няколко модификации, и накрая диборен триоксид (B2O3) с по-нататъшно обезводняване.
Въпреки трите си водородни атома, борната киселина реагира във водата като монопротонова киселина и реагира, образувайки тетрахидроксоборатния йон, B (OH) 4 -. Той не се държи като киселина на Brønsted като донор на протон, а като киселина на Луис като акцептор на хидроксид:
Борната киселина е много слаба киселина (pKa = 9,25). Чрез взаимодействие с многоатомни алкохоли, като манитол, киселинната сила може значително да се увеличи. Това се дължи на изместване на равновесието надясно към тетраоксоборатно производно в резултат на естерификация:
Тази реакция се използва за алкалиметрично титруване на борна киселина.
доказателство
Борната киселина и нейните соли, боратите, образуват летливия метилов естер на борната киселина с метанол и дехидратиращата концентрирана сярна киселина, която гори със зелен пламък и се използва за качествено откриване. [5]
използване
В медицината борната киселина се използва като воден разтвор (Борна вода) и мехлем (Бор мехлем) използва се като лек дезинфектант [6]. След изземването на лекарства, съдържащи борна киселина през 1984 г. от Федералната здравна служба по това време, борната киселина и нейните естери и соли са одобрени само за буфериране и изотонизиране на капки за очи и за използване в хомеопатични разреждания [7]. В хранителната промишленост борната киселина се използва като консервант с обозначението E 284. Борната киселина е междинен продукт при производството на боросиликатно стъкло, порцелан, емайл и също се използва при забавители на горенето и петна. Световното годишно производство на борна киселина е над 200 000 тона.
Друго приложение е използването на разтворена борна киселина във водни ядрени реактори под налягане като абсорбер на неутрон за регулиране на верижната реакция. Той се основава на голямото напречно сечение на абсорбцията на 20% изотоп 10 B за топлинни неутрони в естествен бор. Тук се провежда ядрената реакция
Борната киселина също се използва за изчисляване на съдържанието на въглероден диоксид в геоложки времена. В кисела среда борната киселина все повече се включва в 11 бор. Когато стойността на рН се промени на алкална, борната киселина се превръща в борат, солта на борната киселина. Тъй като фораминиферите (изкопаеми и скорошни едноклетъчни организми) се нуждаят от борат, за да изградят черупката си, съотношението може да се използва, за да се определи коя стойност на рН е присъствала в тази област в кой момент от историята на земята. Тъй като черупките на такива едноклетъчни организми, както и мидите и т.н. съставляват основната част от морския утайка, ядките на утайките могат просто да бъдат отстранени от там и изследвани в лабораторията за двата борни изотопа. Такива резултати корелират добре с въздушните мехурчета, уловени в ледени ядра.
При изгаряне на метилов борат се създава зелен пламък, докато естерите на борната киселина на други алкохоли показват зелена пламъчна линия при изгаряне. Това свойство се използва за идентифициране на метанол (училищен експеримент) [8] и в пиротехниката, например, за оцветяване на пламъците на огнени пръчки, poi или пожарни чаши.
3% разтвор на борна киселина (борна вода) може да се използва при каустични изгаряния. Той сам по себе си не е корозивен и може да неутрализира алкалите.
До 1,3% борна киселина е открита в слуз, продавана като играчки („Slimys“). [9] Вискозитетът на лигавата маса се увеличава със съдържанието на борна киселина. По време на производството трябва да се внимава съдържанието да е постоянно ниско, тъй като трябва да се очакват неблагоприятни ефекти върху здравето, дори ако се консумират само 50 mg/kg телесно тегло. [10]
Списък на опасните вещества
През юни 2010 г. борната киселина беше добавена към списъка на кандидатите за SVHC (вещество, което предизвиква голямо безпокойство) от ECHA. След влизането в сила на Регламент 1272/2008/EG на GHS и Регламент за изменение на REACH 790/2009/EG борната киселина беше етикирана като токсична за репродукцията. Смеси, които съдържат свободна борна киселина в концентрация 5,5% или повече, също трябва да бъдат етикетирани като токсични за репродукцията съгласно регламента за GHS.
- Корегон - биология
- Бореален щит - биология
- Ботаническа градина в Падуя - Биология
- Aquazoo - Музей Löbbecke - Биология
- Adenium obesum - биология