Подход, базиран на тандемна течна хроматография-масова спектрометрия към анализа на метаболита Staphylococcus aureus doi: 10.3791/55558 Публикуван: 28 март 2017 г.
Обобщение
Тук описваме протокол за извличане на метаболити от Staphylococcus aureus и последващия им анализ с помощта на течна хроматография и масспектрометрия.
Резюме
Въведение
Бактериалните патогени са изправени пред много предизвикателства в приемащата среда. В допълнение към директната атака от имунни клетки, гостоприемникът отделя и хранителни вещества, важни за бактериалното оцеляване и репликация, генерирайки хранителен имунитет 1, 2. За да оцелеят в тази враждебна среда, бактериалните патогени прилагат фактори на вирулентност. Някои от тези фактори могат да се използват за избягване на имунния отговор на бактериите; Други фактори са храносмилателните ензими като хиалуронидаза, термонуклеаза и липаза, които позволяват на бактериите да попълват хранителни вещества чрез консумация на тъканни компоненти 3, 4, 5. Всъщност бактериите са разработили регулаторни системи, които свързват физиологичното състояние на клетката с производството на фактори на вирулентност 6, 7, нагоре> 8, 9, 10.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Протокол
1. Приготвяне на буферни разтвори
- Пригответе фосфатно буфериран физиологичен разтвор (PBS; рН 7,4) чрез разреждане на изходен разтвор от 10 × PBS до крайна концентрация 1x с ултрачиста вода (дестилирана и дейонизирана) вода.
- Приготвя се охлаждащ разтвор чрез комбиниране на 2 ml ацетонитрил, 2 ml метанол, 1 ml ултрачист H 2 O и 19 μl (0,1 mM крайна концентрация) мравчена киселина.
- Приготвя се LC-MS разтворител А чрез добавяне на мравчена киселина (0,2% [v/v] крайна концентрация) към ултрачиста вода.
- Приготвя се LC-MS разтворител B чрез добавяне на мравчена киселина (0,2% [v/v] крайна концентрация) към ацетонитрил.
ЗАБЕЛЕЖКА: Всички разтвори трябва да бъдат направени с реагенти с най-висока чистота на разположение (обикновено клас с ВИСОКОЕФЕКТИВНА ТЕЧНА ХРОМАТОГРАФИЯ). Разтворите трябва да се приготвят прясно преди всеки експеримент и да се съхраняват на лед преди употреба.
2. Установяване на стабилен растеж на S. aureus
- Streak S. aureus щамове, представляващи интерес за изолиране върху триптичен соев агар (TSA) от замразен глицеролов разтвор. Инкубирайте при 37 ° С за 16-24 часа.
- Инокулирайте 4 ml триптичен соев бульон (TSB) или друга подходяща среда в стерилни стъклени инкубационни епруветки с отделни колонии от всеки щам. Инкубирайте с наклон (
Ъгъл 70 °) с въртене при 60 оборота в минута (об/мин) при 37 ° C за 16-20 часа.
ЗАБЕЛЕЖКА: Културите през нощта са склонни към кислородни градиенти, ако стандартните процедури, включително описаните в стъпка 2.2, засягат клетъчната физиология. Така че ние използваме многократна стратегия за обратно разреждане, за да осигурим биологично стабилно състояние (вижте стъпки 2.4-3.2, по-долу).
Достигнете 0.8-1.0, субкултивирайте ги в 50 ml 37 ° C на TSB до OD600 от 0.01-0.05 и повторете стъпки 2.4 и 2.5.
0,4-0,5, използвайте серологична пипета, за да отстраните 13 ml култура от колбата и да приложите пробата върху филтрите.
ЗАБЕЛЕЖКА: Важно е да извършите горните стъпки бързо (т.е. в рамките на секунди) и толкова бързо, колкото да осигурите бързото възпиране на течността към клетките, спиране на метаболитната активност.
100 µ L от 0,1 мм силициеви мъниста. Съхранявайте това на сух лед или при -80 ° C.
- Размразете пробите върху мокър лед и поставете клетките в хомогенизатор с четири изблика за 30 s при 6000 оборота в минута, като 2 минути периоди на охлаждане върху сух лед пречат на циклите.
- Избистряйте лизатите за 15 минути в предварително охладена, охладена микроцентрифуга с максимална скорост (т.е. 18 213 xg при ≤4 ° C).
- Прехвърлете супернатантата в чиста реакционна епруветка.
- С помощта на микропипета прехвърлете малка част от пробата в епруветка за микроцентрифуга за количествено определяне на остатъчното съдържание на пептид в стъпка 6; Запазете останалото при -80 ° C.
ЗАБЕЛЕЖКА: Обемът на резервираната проба ще варира в зависимост от анализа на BCA в стъпка 6.1. Тази проба трябва да се съхранява на мокър лед за незабавен анализ или да се замразява при -80 ° C.
6. Анализ на бицинхонинова киселина (BCA)
- Извършете BCA анализ, както е препоръчано от производителя на комплекта, като използвате проби от стъпка 5.4, за да определите остатъчната концентрация на пептид за всяка проба.
8. Партидна корекция на броя на йони
- Определете всяка проба, която да служи като еталонна проба за корекция на партиди (напр. Див тип, реплика 1).
- Изчислете сумата от броя на йони за всички метаболити в референтната проба. Повторете това изчисление за всички проби.
- Разделете общото йонно число на всяка проба с общото йонно число на референтната проба, за да създадете съотношение.
- Разделете йонното число за всеки метаболит в проба на съотношението проба/референт, за да получите много коригирано йонно число за всеки метаболит.
- Разделете броя на коригираните партиди йони за всяка проба, получена в стъпка 8, от пептидната концентрация, определена с BCA анализа в стъпка 6, за да се получи нормализирана стойност за всеки метаболит.
ЗАБЕЛЕЖКА: Нормализираният брой периодично коригирани йони за всеки метаболит в стъпка 9.1 може да бъде сравнен директно между щамове и статистически анализ (напр. U-тест на Mann-Whitney). Алтернативно известно е, че метаболитът може да бъде непроменен или чрез лечение, или генетичен фон може да се използва като устройство за нормализиране за откриване на промени чрез разлагане на метаболита. Включването на известно количество L-норвалин или глурарова киселина в екстракционния буфер може да се използва за коригиране на загубата по време на обработката на пробата 34.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Представителни резултати
Анализирахме вътреклетъчни пулове от метаболитни продукти в S. aureus по време на растеж in vitro в богата комплексна среда. Като доказателство за принципа сравнихме метаболитните профили между чувствителния към метицилин остеомиелит S. aureus, изолиран UAMS-1 (див тип [WT]) и изогенен щам, който няма глобалния транскрипционен регулатор CodY (Δ codY) 26. Стационарни, експоненциални култури на WT и codY щамове бяха установени в TSB среда, както е описано в стъпка 2 от протокола. Поведението на растеж на дивия тип и мутантните cODY-null култури е сходно, само с малки разлики в добива и скоростта на растеж (Илюстрация 1). Използвайки RNA-Seq и технология microarray, ние и други повече гени, отговорни за ензимите, участващи в биосинтеза на аминокиселини, получени от аспартат, бяха депресирани в мутиралия c-null codY в сравнение с WT клетките по време на - in vitro - растеж на TSB (Фигура 2) 25, 27, 30. В допълнение, 30, 35 и brnQ1 и brnQ2, пермеазите за аминокиселини с разклонена верига, са свръхекспресирани в кодовия нулев мутант.
За да определим степента, до която стационарните вътреклетъчни изобилия от метаболити са свързани с този път, променен в нулевия мутант, ние извършваме профилиране на метаболит, базиран на LC-MS. WT и codY-нулеви мутантни клетки се отглеждат до биологично стабилно състояние и се сканират, както е описано в стъпка 4 от протокола. Определихме изобилието на метаболит по пикова интензивност на йона за всяка хроматографско интегрирана метаболитна интеграция с помощта на аналитичен софтуерен пакет (вж. Бил на материалите) Ние коригирахме за различия в биомасата, нормализирана чрез изобилие от метаболити на остатъчната пептидна концентрация на всяка проба. Също така коригирахме тези стойности за възможни партидни ефекти между пробите във всяка проба за всички метаболити, за да изчислим средното йонно число и да използваме пробата от див тип като референтна стойност. Този подход даде възможност за сравнение между пробите между изобилието на метаболити в различни условия. Сравненията между метаболитите в дадена проба могат да бъдат постигнати по подобен начин, като първо се нормализират количествата метаболити от броя на йони, като се използва методът на стандартно добавяне на моларни количества.
Сравнихме нивото на ключови междинни продукти в пътя на аспартата в UAMS-1 и неговия нулев мутант codY. Както в 3 Както може да се види, крайните продукти по този път (напр. Треонин и (изо) -левцин) са богати на кодиращи нулеви мутантни клетки, докато прекурсорите (напр. Аспартат и о ацетил хомосерин) са богати на WT клетки. Комбинираното регулиране на BrnQ прониква 36 и биосинтетичния път на ILV вероятно води до увеличаване на изолевцин и левцин 30. Въпреки че разликите са сравнително малки (29, определени от RNA-Seq анализ, трябва също да се отбележи. DHP, 2,6-диаминохептандиоат ( 2,6-диаминопимелат).
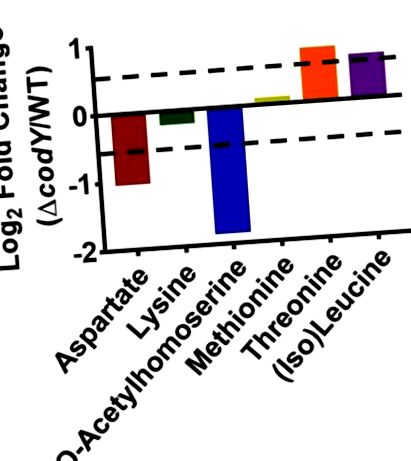
Фигура 3: Честота на метаболитите в аспартата - Семейството се променя в codY мутант. Показани са дневните 2-кратни промени на избрани метаболити в нулевия мутант на cODY в сравнение с UAMS-1 (WT). Промяната се определя чрез разделяне на средната честота на три повторения на codY-нулев биологичен щам на средното изобилие от три биологични повторения на щама WT. Стандартната грешка между биологичните репликати за всеки метаболит беше Изискван абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Дискусия
1.0, разредено обратно до OD 600 от
0,05, отгледани и събрани, когато имат OD 600 от
Достигна 0,5. Такава процедура също разрежда цитоплазмените молекули, включително стабилни РНК, като същевременно се натрупва растеж през нощта. Всъщност RNAIII, ефекторът на agr кворумната сензорна система, е една такава РНК и регулира експресията на някои от същите генни мишени като CodY 25, 43, 44. Кумулативната RNAIII може да маскира CodY-зависима регулация, което води до подценяване на силата на Репресия или стимулация от CodY (Sharma и Brinsmade, непубликувани резултати).
Ограничение на този анализ е, че той дава моментна представа за изобилието от метаболитни продукти в клетката; не могат да се направят заключения от резултатите относно промените в потока през определен път. Например, изобилието на лизин и метионин между двата изследвани щама не може да се промени, въпреки дерепресията на биосинтетичните ензими в codY-нулевия участък (2 и 3). CodY-null щамът всъщност може да произвежда повече лизин и метионин, но те могат бързо да ги превърнат в други съединения; така че тези молекули да не се натрупват. Използването на 13 C или 15 N маркирани източници на въглерод или азот би ни позволило да следваме скелетите на въглерод и азот през основните метаболитни коридори 45, 46.
Използвахме описания метод, за да обясним промените в метаболитните пулове в S. aureus, B. subtilis 29, Mycobacterium tuberculosis 47 и Enterococcus faecium 48, но методът може да се приложи и към други Грам-положителни и Грам-отрицателни бактерии, включително други човешки патогени лесно се култивира в лаборатория. Всъщност метаболомичната и транскриптомната интеграция на информация може да разкрие неочаквани връзки между метаболизма и вирулентността, което може да доведе до нови стратегии за лечение на инфекции.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Разкриване
Авторите заявяват, че нямат финансови интереси.
- Анализ на генната експресия в извор на смарагдов пепел (Agrilus planipennis), използвайки количествено реално
- Dick and Doof Подходът за етикетиране на наднорменото тегло и - GRIN
- BMI калкулатор - калкулатор на индекс на телесна маса
- Индекс на телесна маса, тамоксифен, инхибитори на ароматазата; Влияние на ИТМ върху ефективността на ендокринната система
- Индекс на телесна маса и самооценка на здравословното състояние