Диференцирани функционални роли на генната експресия на имунни и неимунни клетки при миши колит от трансплантация на костен мозък
Обобщение
Трансплантацията на костен мозък предлага начин за промяна на генотипа на клетките, получени от костния мозък. Ако генът, който представлява интерес, е изразен както върху клетки, получени от костен мозък, така и върху клетки, получени от костен мозък, трансплантацията на костен мозък може да промени клетките, получени от костния мозък, в различен генотип, без генотипизиране на клетките, получени от костен мозък.
Резюме
Протокол
А. Преди да започнете технически съображения
* Кратко описание на тестовия протокол е в илюстрация 1 показани.
2. Облъчване на приемни мишки
- Мишките се отглеждат и държат в устройство за патогени. Поставете мишки в автоклавна облъчваща баница с филтри. Поставете мишка във всеки слот на пая за облъчване. Поставете тортата в светлината на прожекторите и се уверете, че грамофона и тортата се въртят.
- Включете въздушната помпа за вентилация. Затворете вратата на нагревателя и го заключете.
- Облъчете мишките с 1000 rad (което се равнява на 10 Gy) за около 10 минути (в зависимост от източника на лъчение и времето на полуразпад). В този момент облъчените мишки са имунокомпрометирани и имунитетът срещу инфекция слаб. След облъчване извадете тортата и я поставете в стерилен контейнер за транспортиране до шкафа за биобезопасност на животните. Избягвайте да давате мишките на външна среда, за да сведете до минимум вероятността от инфекция.
- В шкафа за биобезопасност прехвърлете мишките в автоклавирани клетки за мишки с автоклавирани легла (4 мишки на клетка. Нова стерилна вода със сулфатримна суспензия - 3,12 ml на 100 ml вода).
- Увийте бутилката с вода с алуминиево фолио, тъй като антибиотиците са чувствителни към светлина. Разклатете добре бутилката сулфатрим със сместа, преди да я поставите в клетката.
3. Екстракция на костен мозък на донора
4. Преброяване на клетки донори на костен мозък
- Добавете 100 μl трипаново синьо в епруветка на Eppendorf и 100 μl суспензия на костния мозък в епруветка на Eppendorf и разбъркайте. Пипетирайте оцветената клетъчна смес върху преброителна камера.
- Количеството клетки се изчислява от общата жива площ на броя на клетките на костния мозък в тръбата на Falcon = неоцветен брой клетки в 16 квадрата x 2 (поради разреждане на трипан синьо) x 10 000 x 50 ml
- Центрофугирайте клетките на костния мозък в 50 ml епруветки Falcon при 2000 об/мин за 5 минути при 4 ° C.
- Отстранете супернатантата. Въз основа на общия брой клетки, преоразмерете гранулата с PBS до 1 х 10 8 клетки на ml
5. Инфузия на реципиентни мишки
- Загрейте мишките реципиенти върху нагревателна подложка и под топлинна лампа. Поставете мишките получатели в ограничител. 1 × 10 7 клетки на мишка в 100-200 μl интравенозно.
- Инжектирането на донорен костен мозък трябва да се направи между 4-24 часа след облъчването.
- Придържайте се към 4 инжектирани мишки на клетка. Поддържайте инжектираните реципиентни мишки в автоклавирани клетки с вода, обработена с антибиотици, през първите 4 седмици в животновъдство без патогени и оставете мишките да си възвърнат имунитета. Сменяйте клетки, обработена с антибиотици вода и храна на всеки 4 дни, за да поддържате хигиена.
6. Индукция на колит и оценка на колит
7. Инспекция за качество на трансплантацията на костен мозък с помощта на поточна цитометрия
- Етикетирайте всяка проба от кръв или костен мозък № 1-5:
- Пригответе сместа от антитела за всяка съответна епруветка на тъмно.
# 1 Няма антитяло
# 2 30 µl FITC изотип контрол + 30 µl PE изотип контрол + 15 µl CD16/32 блокиране
# 3 блокиране на 30 µl FITC CD45.1 Ab + 15 µl CD16/32
# 4 30 µl PECD45.2 Ab + 15 µl CD16/32 блокиране
# 5 30 µl FITC CD45.1 Ab + 30 µl PE CD45.2 Ab + 15 µl CD16/32 блокиране
| Не добавяйте нищо към проба от кръв или костен мозък №1 |
| Добавете 5 μl смес от антитела # 2 към всяка проба от кръв или костен мозък # 2 |
| Добавете 3 μl смес от антитела # 3 към всяка проба от кръв или костен мозък # 3 |
| Добавете 3 μl смес от антитела # 4 към всяка проба от кръв или костен мозък # 4 |
| Добавете 5 μl смес от антитела # 5 към всяка проба от кръв или костен мозък # 5 |
- Дръжте на тъмно в лед за 30 минути.
- 2 ml 1X буфер за лизис на еритроцити във всяка епруветка. Дръжте на тъмно върху лед за 15 минути.
- Центрофугирайте клетките при 1500 rpm, 5 минути при 4 ° C. (GH 3.8 ротор, 1500 rpm = 350 xg) Отстранете супернатантата. Пелетата с 500 μl клетъчен буфер за оцветяване на тъмно, след това завихрете за кратко.
- Проверете CD45.1 (еквивалентно на WT) и CD45.2 (KO) в имунооцветените проби от кръв и костен мозък, използвайки поточна цитометрия. Изберете FITC, за да представлява WT CD45.1, а PE представлява KO CD45.2.
- Анализирайте резултатите от поточната цитометрия, използвайки софтуера FlowJo. Изчислете съотношението на съотношението FITC: PE или съотношението PE: FITC, за да определите дали донорски генотип доминиращи генотипове в кръвта и костния мозък.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Представителни резултати
Ако генът, който представлява интерес, играе важна роля в имунните клетки при развитие на колит, мишките, получаващи костен мозък с различен генотип чрез трансплантация на костен мозък (WT KO или KO до WT), трябва да имат променен отговор на DSS колит. Един от най-важните параметри при определяне на тежестта на колита е H&E оцветяването на тъканите на дебелото черво. Промените в структурата на тъканите на дебелото черво и признаците на възпаление могат да бъдат оценени количествено чрез H&E хистологична система за оценка Критерии за H&E хистологично оценяване за DSS модел на колит можете да намерите тук 2. Алтернативно, химически индуциран колит може да бъде индуциран и от тринитробензенсулфонова киселина (TNBS). Методи за индукция на колит на TNBS и критерии за оценка на H&E хистология могат да бъдат намерени в по-ранна публикация 3. Хистологична разлика между групите, анализирани чрез студентски t-тестове.
Мишките могат значително да подобрят или влошат колита при мишки с фалшива трансплантация на костен мозък (WT WT или KO KO). Ако генът, който представлява интерес, играе значителна роля при колит чрез клетки, получени от костен мозък, мишките с разменен костен мозък трябва да реагират значително по-различно от мишките с фалшива трансплантация на костен мозък.
За DSS модел на колит промяната в хистологията може да бъде оценена чрез хистологично оценяване (вж Фигура 4). Значителна промяна в хистологичния резултат може да се дължи на образуването на колит, медииран от гена, който представлява интерес в клетките, получени от костния мозък. Например, кателизидинът е антимикробен и противовъзпалителен пептиден ген (ген, който представлява интерес в нашия случай) 4. Без трансплантации на костен мозък, нокаутиращите мишки с кателицидин обикновено развиват по-лош колит от мишки от див тип в отговор на DSS. Преливането на мишки с кателицидинов нокаут (KO) от костен мозък от див тип (WT) води до облекчен колит, докато преливането на костен мозък от мишки с нокаут от кателицидин (KO) на мишки от див тип (WT) води до влошен колит, когато DSS (Фигура 2) изложени.
За да се потвърди експресията на гена от интерес, експресията на тРНК на гена от интерес (напр. Кателизидин) от донорен див тип костен мозък в дебелото черво (или друга) тъкан на мишки, получаващи дефект на кателизидин, след трансплантация на костен мозък трябва да бъде открита. Също така е интересно да се знае дали експресията на гена от интерес при мишки реципиенти от див тип намалява костния мозък след даряване от нокаутиращи мишки.
Успешната трансплантация на костен мозък на донора е представена от доминиращото съотношение на изотипа на CD на донора спрямо изотипа на CD на реципиента както в периферните кръвни клетки, така и в костния мозък на реципиентните мишки. Костният мозък най-добре показва маркирането на CD45.1 и CD45.2 в поточната цитометрия, тъй като кръвта има много неоцветени клетки (Фигура 2 и 3).
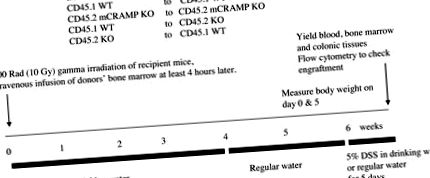
Фигура 1. Експериментален протокол за трансплантация на костен мозък.
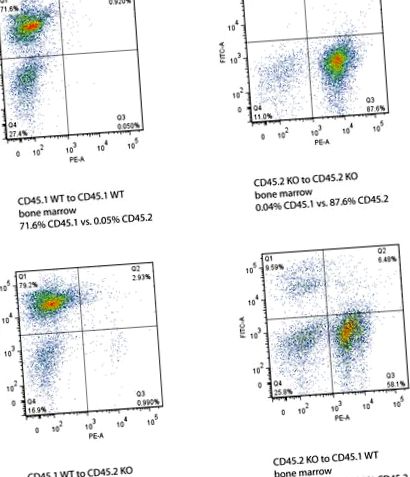
Фигура 2. Данни за поточна цитометрия за мишки реципиенти на костен мозък след трансплантация на костен мозък. Оста Y показва сигнала CD45.1, маркиран с FITC, а оста X показва сигнала CD45.2, маркиран с PE. Успешното костно присаждане се определя от промяната в генотипа CD45.1 или CD45.2 както в костния мозък, така и в кръвта на реципиентните мишки. Щракнете тук, за да видите по-голяма снимка .
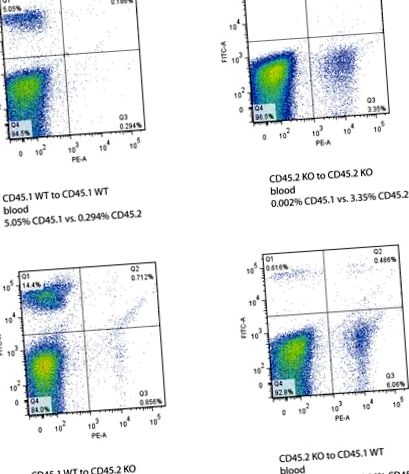
Фигура 3. Данни от поточната цитометрия от реципиентни кръвни мишки след трансплантация на костен мозък. Оста Y показва сигнала CD45.1, маркиран с FITC, а оста X показва сигнала CD45.2, маркиран с PE. Успешното костно присаждане се определя от промяната в генотипа CD45.1 или CD45.2 както в костния мозък, така и в кръвта на реципиентните мишки. Щракнете тук, за да видите по-голяма снимка .
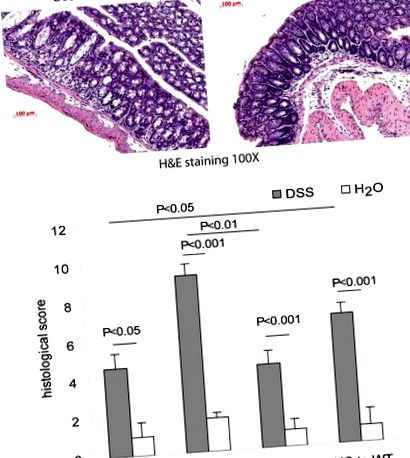
Фигура 4. Оценка на колит при мишки след трансплантация на костен мозък. (A) Примерни H&E изображения на дебелото черво поради нормална хистология и DSS колит. (Б) Хистологични резултати. Успешната индукция на DSS колит може да бъде потвърдена чрез значително увеличаване на хистологичния резултат до 5-ия ден от лечението с DSS. След обмен на костния мозък с различен генотип, хистологичният резултат трябва да се промени значително. Това предполага променен ход на колит, причинен от изразяване на гена, който представлява интерес в клетките, получени от костния мозък. Данните са представени като средна стойност ± стандартно отклонение на средната стойност.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Дискусия
Този подход за трансплантация на костен мозък е подходящ за имунологични изследвания на колит, инфекции, рак, затлъстяване и други заболявания. Този експеримент за трансплантация на костен мозък е необходим, когато генът, който представлява интерес, се изразява както в клетките на костния мозък, така и в клетките, получени от костен мозък, и се предполага, че генът, който представлява интерес, медиира заболяването от клетки от която и да е популация. Например, антимикробният пептид кателизидин е показан да модулира остър колит. Но тя се изразява както в епителните клетки, така и в имунните клетки (макрофаги). След това имаме костни присадки, за да определим коя популация от клетки модулира острия колит при мишки. Тежестта на колита е значително променена след промяна на генотипа на кателизидинов костен мозък чрез трансплантация на костен мозък. Тогава можем да заключим, че кателизидин, експресиран в клетки, получени от костен мозък, играе значителна роля в модулирането на острия колит в отговор на DSS.
От друга страна, има много начини за проследяване на успеха на трансплантацията на костен мозък. Анализът на поточната цитометрия на CD45.1 и CD45.2 генотипове може да бъде количествен метод за определяне на дела на донорните стволови клетки, получени от костен мозък на донора в реципиентните мишки. Получените от костен мозък клетки могат да бъдат диференцирани в няколко типа клетки 10. Ако анализът на поточната цитометрия не е възможен, възможно е да се използват мъжки донорски мишки (XY хромозома) и мишки реципиентки женски (XX хромозома) 11. Донорните мишки носят уникални Y хромозоми в тялото на XX само женски мишки реципиенти. Y хромозомата може да бъде идентифицирана чрез флуоресценция in situ хибридизация 11. Освен това може да се наложи имунохистохимия на CD45.1, CD45.2 и/или гена от интерес в тъканите, за да се визуализират клетките, получени от донорен костен мозък.
Но CD45 поточен цитометричен анализ и Y хромозома in situ процедури за хибридизация обикновено се извършват след убиването на мишките. За да се следи положението на донорните клетки в реципиентните мишки, използвани за наблюдение на хронични заболявания като рак, без да се правят мишките, които се изследват, е възможно да се използват зелени флуоресцентни протеинови трансгенни мишки като мишки донори 12. Следователно, клетки, получени от донорната костна клетка, могат да бъдат проследени в тялото на реципиентните мишки, като се използва неинвазивно оптично изображение с висока разделителна способност при преходна анестезия и това може да се прави многократно.
Не всички мишки имат успешна трансплантация на костен мозък 13. Наблюдавахме,
10-20% от мишките умират от анемия или инфекция през първите 2 седмици след облъчването. Следователно, повече мишки от необходимото трябва да бъдат направени в началото на експеримента. Например, трябва да подготвите 10 мишки на група в началото на експеримента, ако очаквате 8 мишки на група до края на експеримента с колит. Така че, уверете се, че премахвате мъртвите мишки възможно най-скоро. Скоростта на имунно възстановяване е свързана с броя на хематопоетичните стволови клетки в костния мозък, инфузирани в реципиентни мишки 14. Следователно е от решаващо значение да има достатъчен брой живи клетки от костен мозък (1 х 10 7 клетки на мишка), инфузирани в реципиентни мишки за успешна трансплантация на костен мозък.
Получаващите мишки след облъчване бяха с нарушен имунитет. Процедурите за дисекция на донорски мишки и подготовка на костен мозък трябва да се извършват по същия стандарт като експериментите с клетъчни култури. Използвайки стерилни инструменти и контейнери, трябва да се прилагат асептични условия. Във всички експерименти PBS съдържа 1% пеницилин-стрептомицин и 10 U/ml хепарин трябва да се използва при манипулиране на кости от кратуна. Всички реактиви са за клетъчна култура. Допълнителна техническа дискусия може да се намери в препратка 13.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Разкриване
Няма деклариран конфликт на интереси.
Благодарности
Тази работа е финансирана от пилотно проучване за осъществимост от UCLA-CURE Center, болестта на Crohn's and Colitis Foundation of America за кариерно развитие (# 2691) и Националния здравен институт NIDDK K01 (DK084256) финансиране за Hon Wai Koon.
Операцията за облъчване на костен мозък е подкрепена от Bernard Levin и Scott Kitchen от UCLA Center for AIDS Research Mouse/Human Chimera Core Facility. Операцията на поточна цитометрия се поддържа от съоръжението Vector Core на UCLA.
- Капацитет на диференциация на човешки аортни периваскуларни адипозни прогениторни клетки (в превод
- Модел на хиперандрогенна мишка за изследване на протокол за синдром на поликистозен яйчник (преведен на немски)
- Новият завинаги млад - просто останете млади с 4-седмичната програма за успех „Захранване за вашите гени“
- Видове елиминиране di; десет - Функционална храна - 2020
- Модел на мишка на протокол за частична обструкция на червата (преведен на немски)