FOXO - транскрипционни фактори при хематопоетични тумори
| Телефон + 49-731-500- | Електронна поща | |
| Д-р Алексей Ушморов | 33 847 | [email protected] |
| Телефон + 49-731-500- | Електронна поща | |
| Франц Еретик | 33 831 | [email protected] |
| Д-р Франциска Герингер | 33 831 | [email protected] |
| Анита Кик | 23 264 | [email protected] |
От 2010 г. изследваме ролята на транскрипционните фактори на FOXO в патогенезата на В-клетъчните новообразувания. FOXO принадлежат към семейството на транскрипционни фактори FOX O, всички от които имат силно запазен ДНК-свързващ домейн „forkhead“, но се различават по структурата на транзактивационните домейни, което обяснява техните частично не-излишни функции. Клетъчните функции на FOXO включват регулиране на клетъчната смърт, клетъчната пролиферация, защита от реактивни кислородни видове, реагиране на увреждане на ДНК и клетъчен метаболизъм (включително липогенеза и глюконеогенеза). Въпреки че членовете на семейството FOXO са експресирани във всички тъкани, има очевидна количествена разлика в тяхното тъканно разпределение. FOXO1 по-специално е силно експресиран в В клетки. FOXO1 е от съществено значение за оцеляването и диференциацията на В-клетките в ранните етапи от развитието на В-клетките, както и за реакцията на зародишния център, която е отговорна за афинитетното съзряване на рецептора на В-клетките.
Репресията на FOXO1 допринася за блокадата на диференциацията на плазмените клетки при класически лимфом на Ходжкин (cHL)
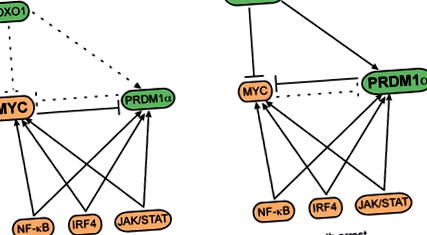
През 2012 г. (Xie L. et al., Blood, 2012) се фокусирахме върху ниската експресия на FOXO1 в cHL в сравнение с нормалните В-клетки и неходжкиновите В-клетъчни лимфоми (NHL). cHL е В-клетъчен лимфом, който до голяма степен е загубил своята В-клетъчна програма. Показахме, че свръхекспресията на FOXO1 в клетъчните линии на cHL индуцира апоптоза и стигнахме до заключението, че FOXO1 е туморен супресор в cHL. И накрая, ние изследвахме молекулярните ефекти на свръхекспресията на FOXO1 в cHL с помощта на профили на генна експресия. Идентифицирахме основния регулатор на диференциацията на плазмените клетки, PRDM1, като транскрипционна цел на FOXO1, която медиира неговата туморна супресорна функция. В допълнение успяхме да покажем, че туморният супресиращ ефект на PRDM1 зависи от регулиране надолу на протоонкогена MYC (Фиг. 1). Ние също така предположихме, че ниската експресия на FOXO1 е отговорна за характерния фенотип на "абортираща диференциация на плазмените клетки" на клетките на Ходжкин и Рийд-Щернберг, злокачественият компонент на cHL.
Фина регулация на FOXO3A в cHL като механизъм за оцеляване и индикатор за неуспешна диференциация на плазмените клетки
При по-нататъшното изследване на ролята на FOXO1 в В-клетъчните лимфоми, ние се фокусирахме върху реципрочния характер на експресията на mRNA на FOXO1 и FOXO3A в процеса на диференциация на B-клетките от зародишните централни клетки на тъмната зона (DC) към плазмените клетки (PZ). Нивата на експресия на FOXO1 намаляват в хода на терминалната диференциация от DZ B клетката до PZ, докато нивата на mRNA на FOXO1 се увеличават. Установихме, че нивата на иРНК на FOXO3A са по-високи в cHL, отколкото в DZ B клетките, но по-ниски, отколкото в PZ. Също така показахме, че тези междинни нива на експресия на FOXO3A са от съществено значение за оцеляването на cHL, тъй като увеличаването или намаляването на количеството на FOXO3A е неподходящо (Фиг. 2).
Следователно стигнахме до заключението, че cHL клетките поддържат тези нива на експресия на FOXO3A/FOXO1, които отразяват диференциращия статус на нормалната прогениторна клетка на cHL и че поддържането на програмата за пролиферация и оцеляване на тази нормална прогениторна клетка е от съществено значение за оцеляването на cHL. По този начин ние постулирахме принципа на „Goldilocks“ за ефектите FOXO при В-клетъчен лимфом.
Фиг. 2. Фина настройка на FOXO3A в cHL като механизъм за оцеляване и отличителен белег на абортираща диференциация на плазмените клетки (Osswald CD, et al., 2018)
Плътното регулиране на FOXO1 е от съществено значение за поддържането на B-ALL
В търсене на подкрепа за нашата хипотеза „Goldilocks“ открихме, че B-ALL, който е много чувствителен към FOXO-активиращи лечения (напр. Инхибитори на AKT или свръхекспресия на FOXO1), поддържа високи нива на експресия на FOXO1 в ядрата посочва роля за FOXO1 в B-ALL. Ние показахме, че генетичното инхибиране на FOXO1 индуцира спиране на растежа и апоптоза в B-ALL клетъчни линии (Фиг. 3). Най-важното обаче е, че фармакологичното инхибиране на FOXO1 показва анти-левкемична активност в няколко първични проби от ксенографт, получени от педиатрични пациенти, с ефективно намаляване на левкемията в хематопоетичните, лимфоидните и централните нервни отдели. Това в крайна сметка доведе до повишена преживяемост без рецидив на левкемия в предклиничен in vivo модел на B-ALL. Тези резултати предполагат, че репресията на FOXO1 може да бъде възможен подход за лечение на B-ALL.
Фиг. 3. Плътната регулация на FOXO1 е от съществено значение за поддържането на В-клетъчен предшественик остра лимфобластна левкемия (Fan W. et al., Blood, 2018).
В лимфома на Бъркит (BL) насърчава разпространението и програмата за оцеляване на тъмната зона на зародишния център и може да служи като фармакологична цел
Когато анализирахме нашите стари данни за експресия на FOXO1 в подтипове В-клетки на NHL, успяхме да определим висока експресия на FOXO1 в ядра на BL. С помощта на експерименти за „загуба на функция“ идентифицирахме антипролиферативен ефект от нокдауна на FOXO1 в BL клетъчни линии, който е свързан с потискането на B клетъчната програма на DC, включително експресията на MYB, CCND3, RAG2, BACH2 и CXCR4, тръгна заедно. В допълнение се наблюдава индукцията на сигналните пътища на светлинната зона, като NF-κB и PI3K-AKT. С помощта на „спасителен“ експеримент, ние идентифицирахме регулирането надолу на протоонкогена MYB като критичен фактор, който допринася за антипролиферативния ефект на нокаута на FOXO1. В опит да се оцени практичността на фармакологичната репресия на FOXO1, ние открихме, че инхибиторът на FOXO1 с ниско молекулно тегло AS1842856 предизвиква клетъчна смърт и спиране на растежа в BL клетъчни линии при ниски концентрации. Както при cHL и B-ALL, ние също така наблюдавахме в BL клетъчните линии, че свръхактивирането на FOXO1 също индуцира инхибиране на растежа, което показва важността на стриктното регулиране на активността на FOXO1 в BL (фиг. 4).
Фиг. 4.FOXO1 осигурява поддържане на програмата за разпространение и оцеляване в тъмната зона и може да бъде фармакологично насочена към лимфома на Burkitt (Gehringer F., et al., Cancers, 2019).
За поддържане на BL е необходима физиологична активност PTEN-PI3K-AKT
При изследване на ролята на FOXO1 в програмата за оцеляване и разпространение на BL, ние също разгледахме очевидния парадокс на преобладаващо ядрената експресия на FOXO1 и твърдяната висока активност на FOXO-инактивиращия PI3K-PDPK1-AKT сигнален път в BL. Установихме, че активността на PI3K-PDPK1-AKT не надвишава физиологичните стойности, типични за В клетките на зародишния център, от който се получава BL. Както свръхекспресията на конститутивно активната версия на AKT (myrAKT), така и нокдаунът на естествения инхибитор на сигнала PI3K-AKT PTEN доведоха до инактивирането на FOXO1 и потиснаха DC пролиферацията и програмата за оцеляване и по този начин растежа на BL (фиг. 5).
Фиг. 5. Физиологични нива на активността на оста PTEN-PI3K-AKT са необходими за поддържане на лимфома на Burkitt (Gehringer F., et al., Leukemia, 2020).
Основните ни резултати
- Ясна класификация на транскрипционните фактори на FOXO и техните регулаторни сигнални пътища като "туморни супресори" и "онкогени" при В-клетъчни неоплазии не е възможна.
- При някои В-клетъчна левкемия и лимфоми дейностите на FOXO се поддържат в „точно подходяща“ зона „Goldliocks“.
- Селективна фармакологична модулация на дейностите на FOXO може да се използва за лечение на В-клетъчна левкемия и лимфом.
Peter Möller и Frank Leithäuser, Институт по патология, Университет в Улм
Ранди Гаскойн и Кристиан Щайдл. Катедра по патология и лабораторна медицина, Център за лимфоидни ракове и Център за транслационна и приложна геномика, Ванкувър, Канада
Рубен Туз, Секция по експериментална хематология, Институт по рак и патология в Лийдс, Университет в Лийдс, Лийдс, Великобритания
Физиологичните нива на активността на оста PTEN-PI3K-AKT са необходими за поддържане на лимфома на Burkitt.
Gehringer F, Weissinger SE, Möller P, Wirth T, Ushmorov A.
Левкемия. 2019 ноември 12. doi: 10.1038/s41375-019-0628-0.
FOXO1 препоръчва поддържане на програмата за разпространение и оцеляване в тъмната зона и може да бъде фармакологично насочена при лимфома на Бъркит.
Gehringer F, Weissinger SE, Swier LJ, Möller P, Wirth T, Ushmorov A.
Раци (Базел). 2019 г., 25 септември; 11 (10). pii: E1427. doi: 10.3390/рак11101427.
FOXO при В-клетъчна лимфопоеза и В-клетъчна неоплазия.
Ушморов А, Вирт Т.
Semin Cancer Biol.2018 юни; 50: 132-141.
Плътната регулация на FOXO1 е от съществено значение за поддържане на В-клетъчен предшественик остра лимфобластна левкемия.
Wang F, Demir S, Gehringer F, Osswald CD, Seyfried F, Enzenmüller S, Eckhoff SM, Maier T, Holzmann K, Debatin KM, Wirth T, Meyer LH, Ushmorov A.
Кръв. 2018 април 5. pii: кръв-2017-10-813576. doi: 10.1182/кръв-2017-10-813576.
Фина настройка на FOXO3A в cHL като механизъм за оцеляване и отличителен белег на абортиращата диференциация на плазмените клетки.
CD Osswald, Xie L, Guan H, Herrmann F, Pick SM, Vogel MJ, Gehringer F, Chan FC, Steidl C, Wirth T, Ushmorov A.
Кръв. 2018 5 април; 131 (14): 1556-1567. doi: 10.1182/кръв-2017-07-795278.
Активиране на онкогенни пътища при класически ходжкинов лимфом чрез децитабин: Обосновка за комбинация с инхибитори с малко молекулно тегло.
Swerev ™, Wirth T, Ushmorov A.
Int J Oncol. 2017 февруари; 50 (2)
FOXO при В-клетъчна лимфопоеза и В-клетъчна неоплазия.
Ушморов А, Вирт Т.
Semin Cancer Biol. 2017 31 юли.
- Вестник @ RupertoCarola - Хайделбергски университет
- Изгубени в битка Собственост на воин, открит на бойното поле от бронзовата епоха - Университет
- Международни семинари по Източноевропейски епистемологични университети в Ерфурт
- Надежда за пациенти с хроничен запек Университет в Любек
- Хирургия на ръцете - Университет в Регенсбург