Измерване на скоростта на реакцията
На последната страница открихме, че скоростта на химична реакция се влияе от три важни фактора: концентрацията на изходните материали, степента на разделяне на изходните материали и температурата. Колкото по-висока е концентрацията на реагента, толкова по-голяма е степента на разделяне и колкото по-висока е температурата, толкова по-висока е скоростта на реакцията.
На тази страница искаме да се справим с въпроса как човек може точно да измери скоростта на реакцията. Два процеса играят важна роля в училищната химия, обемното измерване и гравиметричното измерване.
Обемно измерване на скоростта на реакцията
Когато цинкът реагира със солна киселина, видяхме, че скоростта на реакцията се увеличава с концентрацията на солна киселина. С двойно концентрирана солна киселина реакцията трябва да протече приблизително два пъти по-бързо. Но това също ли е вярно? За да се провери този въпрос, скоростта на реакцията трябва да бъде измерена количествено, т.е.изразимо с точни числа.
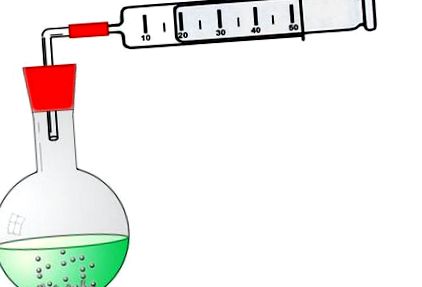
Методът за обемно измерване се основава на измерване на обема на газ, образуван по време на реакцията. Реакцията между солна киселина и цинк произвежда газовия водород. Обемът на водорода, получен по време на реакцията, може да бъде измерен прецизно с газова спринцовка. За да направите това, разгледайте следната фигура:
Полученият водород изтласква буталото на газовата спринцовка навън и с помощта на скалата можете да отчетете точно колко мл H2 газ са се образували в даден момент от времето.
Използваната газова спринцовка трябва да бъде много лесна за придвижване, така че изтичащият водород да избута буталото навън. Ако държите буталния пробоотборник вертикално надолу с ръка, буталото трябва плавно да се плъзга от буталния пробоотборник. След това можете да го хванете с другата ръка.
От друга страна, буталото не трябва да стои прекалено свободно в пробата на буталото. Ако настроите експеримента, както е показано на илюстрацията - с извадено бутало - не трябва да можете просто да натиснете буталото в газовата спринцовка. Ако това успее, буталото е твърде хлабаво. По време на експеримента водородът може да излезе навън отвъд колбата и само част от образувания обем газ ще бъде измерена.
При извършване на действителния експеримент, разбира се, буталото трябва да бъде натиснато докрай в буталото.
По време на този опит може да се случи да използвате твърде много солна киселина. След това реакцията протича много бързо и спринцовката за газ се пълни напълно с газ в рамките на няколко секунди. Разбира се, учениците могат да заснемат буталната спринцовка със своя смартфон и след това да анализират видеото секунда след секунда.
Нека си припомним отново уравнението на реакцията:
За производството на една молекула водород са необходими две молекули солна киселина. Нека приемем, че газовата спринцовка притежава обем от 100 мл. При стайна температура водородът има моларен обем между 22,4135 литра [1] и 22,2469 литра [2]. Средната стойност между тези две цифри е някъде около 22,3 литра и ние просто ще продължим да разчитаме на това.
Така че 1 mmol от газа има обем от 22,3 ml и ако разделим 100 ml от спринцовката за газ на тази стойност, получаваме 4,48 mmol водород. За да се получат тези 4.48 mmol Н2, са необходими 8.96 mmol НС1. Ако използваме 1 моларна солна киселина, това количество вещество се съдържа точно в 8,96 ml HCl. Тъй като вероятно никой ученик не може да измери това толкова точно и вероятно също няма ученик, ние използваме точно 9 мл. Ако е тогава 10 мл, това също не е лошо.
Не трябва да претегляме цинка в експеримента, стига да има явен излишък.
Заснех експеримента през май 2011 г. и успях да запиша подробно увеличаването на обема на водорода в газовата спринцовка. След това завършеният филм беше внимателно анализиран; Измерените стойности се отчитат всяка пълна секунда и се въвеждат в електронна таблица (Excel). Ето графичното представяне на измерените стойности:
Можете да видите много добре крива на насищане; С течение на времето се образува все по-малко водород в секунда.
Ако сега представите разликите (математически първото производно на кривата на насищане), ще получите следната графика:
Тази графика показва, че в началото се получава много водород в секунда, но с течение на времето производството на водород за единица време намалява. Кривата не показва нищо друго освен намаляване на скоростта на реакцията. В този пример реакцията завършва след 16 секунди.
Скоростта на реакция vR е мярка за количеството вещество от продукта на реакцията, произведено за единица време (минута или секунда).
Както лесно можете да видите, скоростта на реакцията намалява все повече и повече, в края се приближава до нула. Това също е логично: все повече солна киселина се консумира в хода на реакцията, докато накрая не остане нищо. И ако в колбата на Ерленмайер вече няма HCl, също не може да се образува водород - скоростта на реакция на образуването на Н2 е нула.
Гравиметрично измерване на скоростта на реакцията
Съвсем различен метод за измерване на скоростта на реакцията се възползва от факта, че газът, който излиза по време на реакцията, има определена маса. Реакциите, при които се отделя водород, не са подходящи за този процес, тъй като водородният газ има много ниска маса (2 g/mol). Този метод е подходящ за реакции, при които се отделя въглероден диоксид. При 44 g/mol CO2 има значително по-висока маса.
екзекуция
За реакция, при която се отделя водород, ви е необходима много чувствителна скала, за реакции, които произвеждат въглероден диоксид, е достатъчна нормална училищна везна, която тежи с точност до 0,1 g. Този експеримент има за цел да изследва реакцията на солна киселина (или оцетна киселина) с калциев карбонат.
Поставете колбата на Ерленмайер (за предпочитане с широко гърло) или бехеровата чаша върху везните, поставете точно измерената киселина в съда и настройте везните на нула (функция на разкъсване). След това калциевият карбонат (в излишък!) След това се добавя към киселината възможно най-бързо и дисплеят на скалата се заснема. След като реакцията приключи, видеото се оценява.
оценка
Ако експериментът протича по план, показването на везната трябва да показва все по-малко тегло или маса. Намаляването на масата в секунда трябва да бъде много голямо в началото на реакцията и трябва да става все по-малко и по-малко в хода на реакцията.
Тогава загубата на тегло може да се използва за изчисляване на масата на въглероден диоксид, произведен в секунда, и от това на свой ред количеството солна киселина, все още присъстващо в колбата. След това от n (HCl), c (HCl) може да се изчисли като функция от времето и да се представи графично.
Други методи за измерване на скоростта на реакцията
В допълнение към обемните и гравиметричните методи има и други методи за измерване на скоростта на реакцията.
Методи за реакции, които произвеждат багрила
Ако химическата реакция произвежда багрило като продукт, концентрацията на това багрило може да бъде измерена с фотометър. Това е основно устройство, което определя колко светлина "преминава" през проба от багрилото. Такъв фотометър се състои от източник на светлина, контейнер за проби и фотосензор. Ако концентрацията на багрилото в контейнера за проби е висока, се пропуска само малка част от светлината. От друга страна, ако концентрацията на багрилото е малка, се предава много светлина. Ако такъв фотометър е свързан към автоматичен рекордер или компютър, промяната в концентрацията на багрилото по време на реакцията може да се записва непрекъснато.
Методи за реакции, при които багрилата се обезцветяват
Ако изходен материал от химичната реакция е багрило и това багрило е обезцветено по време на реакцията, намаляващата концентрация на изходния материал може да се проследи с фотометър.
Но и тук е по-лесно. Например можете да спрете времето, необходимо на багрилото да се обезцвети напълно. Тогава обаче определено няма да получите моментна скорост, а само много груба стойност за средната скорост във времевия интервал. Ако искате да определите концентрационната зависимост на скоростта на реакцията по този начин, трябва да извършите няколко паралелни експеримента с различни изходни концентрации.
Интересен вариант на този процес се споменава в някои училищни книги като „Химия днес“ от Schroedel-Verlag. Тиосулфатен разтвор с известна концентрация се комбинира с 1 моларна солна киселина и колбата на Erlenmeyer се поставя върху лист бяла хартия, върху която предварително е нарисуван черен кръст. След това измервате времето, което минава, преди вече да не можете да видите кръста, когато погледнете отгоре в колбата на Ерленмайер. Колкото по-концентриран е разтворът на солна киселина или тиосулфат, толкова по-бърза е реакцията.
Методи за реакции, при които се генерира или консумира киселина/основа
Ако реакцията произвежда киселина, концентрацията на протона се увеличава по време на реакцията. В най-простия случай към реакционната смес се добавя универсален индикатор и цветовите промени се проследяват с невъоръжено око, видеокамера или фотометър.
Ако това не е възможно по някаква причина, можете също така да вземете малки проби от реакционната смес на определени интервали от време и след това да определите съответната им стойност на рН, за да получите информация за протонната концентрация, преобладаваща в момента. Има обаче проблем с този метод: реакцията продължава в пробите, ако нищо не се прави по този начин (бързо охлаждане, добавяне на инхибитор и т.н.).
Ако в реакцията се консумира киселина, можете да продължите по същия начин. Същото се отнася, ако по време на реакцията се създаде или консумира луга.
Добре известен училищен експеримент, в който се използва този процес, е естерификацията на оцетната киселина с етанол за образуване на етилацетат. Реакцията протича много бавно, докато се установи химическото равновесие, понякога часове. На всеки 10 или 15 минути се взема малка проба от реакционната колба и след това се титрува с 1 моларен NaOH, за да се определи концентрацията на киселина в реакционната колба в момент t.
В настоящия ми курс по химия (януари 2019 г.) изследвахме реакцията на солна киселина с цинк по този начин. Методът с непрекъснато измерване на стойността на рН (не е използван индикатор, но рН-метър) премина много добре.
Методи за реакции, при които се генерират или консумират йони
Ако по време на реакцията се образуват йони или ако се консумират йони, може да е възможно да се наблюдават концентрациите на изходните материали или продукти чрез промяна на електрическата проводимост. За целта обаче трябва да се знае точния принос на отделните видове йони към общата проводимост на разтвора. Протоните например имат много по-висока проводимост от сулфатните йони, защото са по-малки и по-мобилни.
- internetchemie.info/chemie-lexikon/daten/m/molvolume.php
- Römpp Chemie-Lexikon, 9-то издание 1992 г.
Тук ще научите как да определите количествено скоростта на химична реакция с просто училищно оборудване.
05.12.2007: Страницата е създадена
03.06.2011: Страницата е преработена, преработена и допълнена
21.03.2015: Страницата е интегрирана в полето за съдържание 1
10 януари 2016 г .: Преработена страница в HTML 5
- Измерване на К; rperfett - аптека за слънце
- Измерване на К; телесни мазнини - B; рен аптека
- Измерване на К; rperfett - аптека Kranich
- Кетонът (и други стойности) е твърде висок - форум за флуорохинолоните
- Изградете сами табуретка от стара автомобилна гума и въже от сезал